L’acétyl-Coenzyme A
L’acétyl-coenzyme ou acétyl-CoA) est une enzyme essentiellement présente au niveau du foie, du tissu adipeux et des glandes mammaires. L’acétyle-Coenzyme-A est la forme biologique activée de la molécule d’acétate. Sous cette forme biologique, l’acétate est estérifié par un groupement thiol du Coenzyme-A.
La vitamine B5 ou acide pantothénique est à la base de la structure de ce coenzyme. Cette forme libre est notée CoA–SH. C’est ce groupement thiol réactif (–SH) qui est impliqué dans la fonction thioester avec les radicaux acyles provenant des acides carboxyliques, comme les acides gras, ou simplement l’acétate comme dans le cas de l’acétyl-CoA.
Origine de l’Acétyl Coenzyme-A
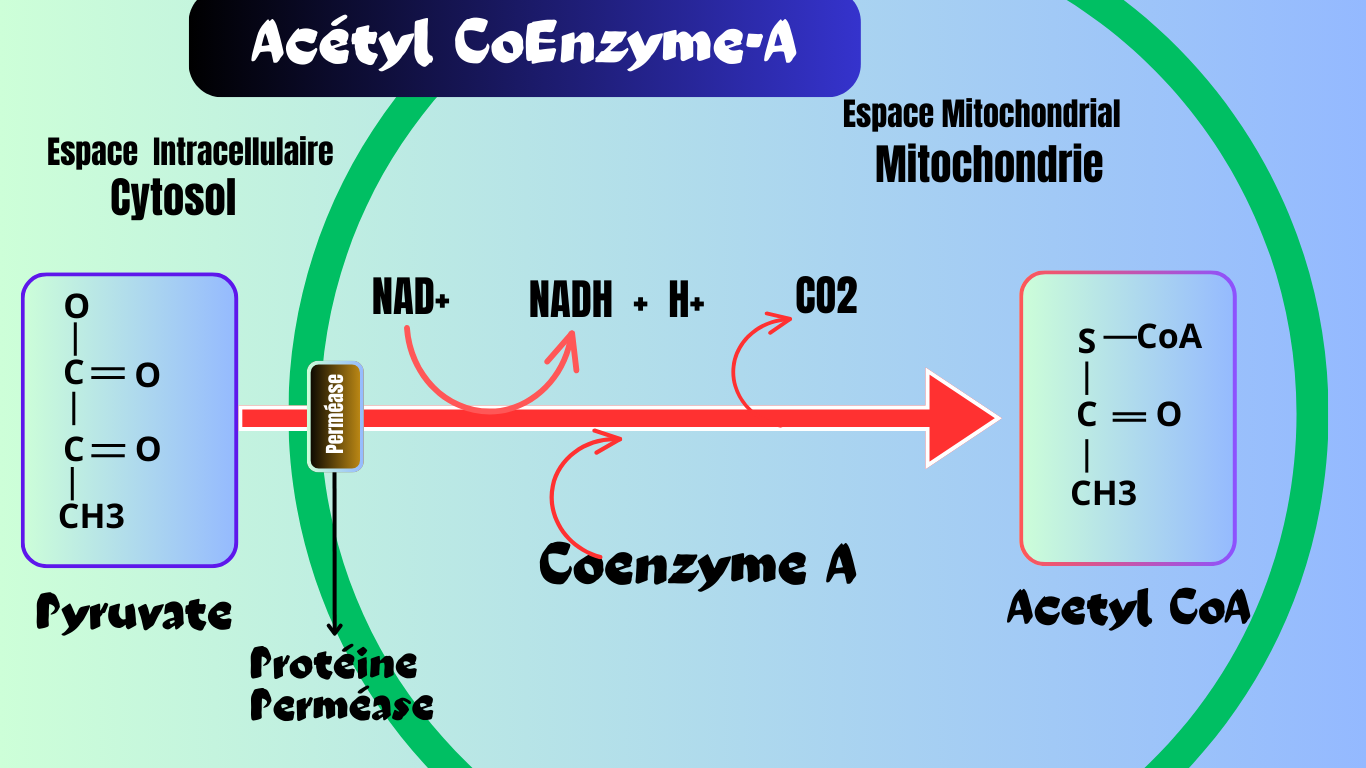
L’acétyl-CoA peut avoir différentes origines au cours du métabolisme cellulaire, selon la nature des molécules à partir desquelles les cellules tirent de l’énergie. Lorsqu’une cellule utilise des sucres comme le glucose, celui-ci se transforme en deux molécules de pyruvate par la glycolyse et ensuite le pyruvate est oxydé et décarboxylé en acétyl-CoA par les réactions de la décarboxylation oxydative catalysée par le complexe pyruvate déshydrogénase dans le complexe mitochondrial et notamment chez les Eucaryotes, cad, les cellules possédant un vrais noyau.
Activité de l’Acétyl coenzyme-A
L’acétyl-CoA (acétyle coenzyme A) participe à de nombreuses réactions biochimiques du métabolisme des protéines, des glucides et des lipides. Sa fonction principale est de livrer le groupe acétyle au cycle de l’acide citrique (cycle de Krebs) pour être oxydé en vue de la production d’énergie .
Elle intervient dans le processus de synthèse des acides gras. La coenzyme-A transporte les acides gras à travers le processus catabolique et d’oxydation dans les mitochondries et transfère les groupes acétyle pendant le processus d’élongation de la synthèse des acides gras dans le cytosol.
Le bilan global de la réaction
Pyruvate + NAD+ + CoA–SH → acétyl–CoA + NADH_+ H+_ + CO2
C’est une réaction thermodynamiquement irréversible. Lorsqu’une cellule utilise des lipides, les réactions de la β-oxydation des acides gras aboutissent également à la formation d’acétyl-CoA. La dégradation des protéines peut également former de l’acétyl-CoA, car certains acides aminés céto-formateurs, le cas d’Isoleucine, de la Leucine et de la Lysine sont dégradés en passant par cet intermédiaire métabolique.
L’acétyl-CoA représente un nœud clé du métabolisme en raison de son intersection avec de nombreuses voies et transformations métaboliques. De nouvelles preuves révèlent que les cellules surveillent les niveaux d’acétyl-CoA en tant qu’indicateur clé de leur état métabolique, par le biais de modifications distinctives de l’acétylation des protéines dépendant de ce métabolite.
Le modèle conceptuel suivant permet de comprendre le rôle de ce métabolite sentinelle dans la régulation métabolique. Des quantités élevées d’acétyl-CoA nucléo-cytosolique sont la signature d’un état de « croissance » ou de « nutrition » et favorisent son utilisation pour la synthèse des lipides et l’acétylation des histones. En revanche, dans les états de « survie » ou de « jeûne », l’acétyl-CoA est dirigé de préférence vers les mitochondries pour favoriser les activités dépendantes des mitochondries, telles que la synthèse de l’ATP et des corps cétoniques. Les fluctuations de l’acétyl-CoA dans ces compartiments subcellulaires permettent la régulation des modifications par acétylation au niveau du substrat, mais nécessitent également la fonction des sirtuines désacétylases pour catalyser l’élimination des modifications spontanées qui pourraient être involontaires. Ainsi, la compréhension des sources, du devenir et des conséquences de l’acétyl-CoA en tant que transporteur d’unités à deux carbones a commencé à révéler son influence sous-estimée mais profonde sur la régulation de nombreux processus vitaux.
Lexique
Les sirtuines chez les mammifères comptent, sept membres (SIRT1 à 7), Silencing Information Regulator Two 1-7), impliqués dans les processus cellulaires, cad, dans la régulation de la transcription, dans le métabolisme, dans le cycle cellulaire, dans la survie et la mort cellulaires [1]. Sir2p, produit du gène Silencing Information Regulator 2, a été découvert en 1986 chez la levure Saccharomyces cerevisiae, et sa suppression diminue la longévité.
L’activation des sirtuines est obtenue par des substances connues pour leurs effets améliorant la longévité, comme le resvératrol, la curcumine, l’EGCG du thé vert ou l’acide alpha-lipoïque et certaine coenzyme comme l’Ubiquinol-10, qui agissent sur les voies métaboliques.