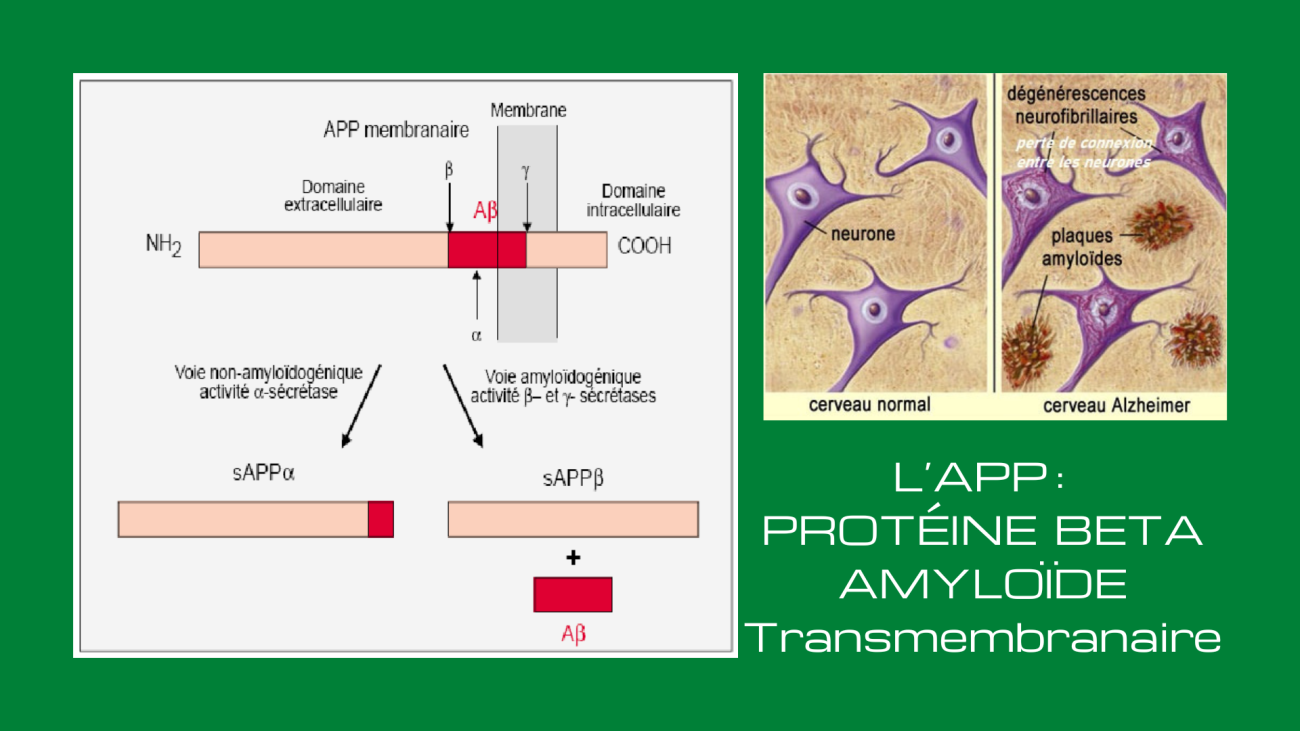
La Protéine Béta-Amyloide. L’APP est une protéine transmembranaire, c’est-à-dire située à travers la membrane des neurones. Elle est très présente dans le système nerveux central où on la retrouve à l’extrémité des synapses. L’APP, tout comme la bêta-amyloïde qui en est issue, est donc un composant normal de l’organisme. L’APP aide par exemple les neurones à croître, à survivre et à se réparer quand ils subissent des lésions.
Site & Mécanisme d’action
Pour libérer la bêta-amyloïde, l’APP doit être coupée à deux endroits par des enzymes particulières. Les bêta-sécrétases vont d’abord couper la chaîne d’acides aminés de l’APP à une certaine distance de la membrane à l’extérieur de celle-ci. Puis, d’autres enzymes, les gamma-sécrétases, vont faire une autre coupure, cette fois à l’intérieur même de la membrane, libérant ainsi le peptide bêta-amyloïde. La longueur de ce peptide bêta-amyloïde est variable, allant de 38 à 42 acides aminés. Les deux formes principales sont toutefois celles à 40 et 42 acides aminés, la seconde étant celle qui a tendance à s’agglutiner pour former les plaques amyloïdes responsables des dégénérescences neurologiques, notamment la maladie d’Alzheimer. 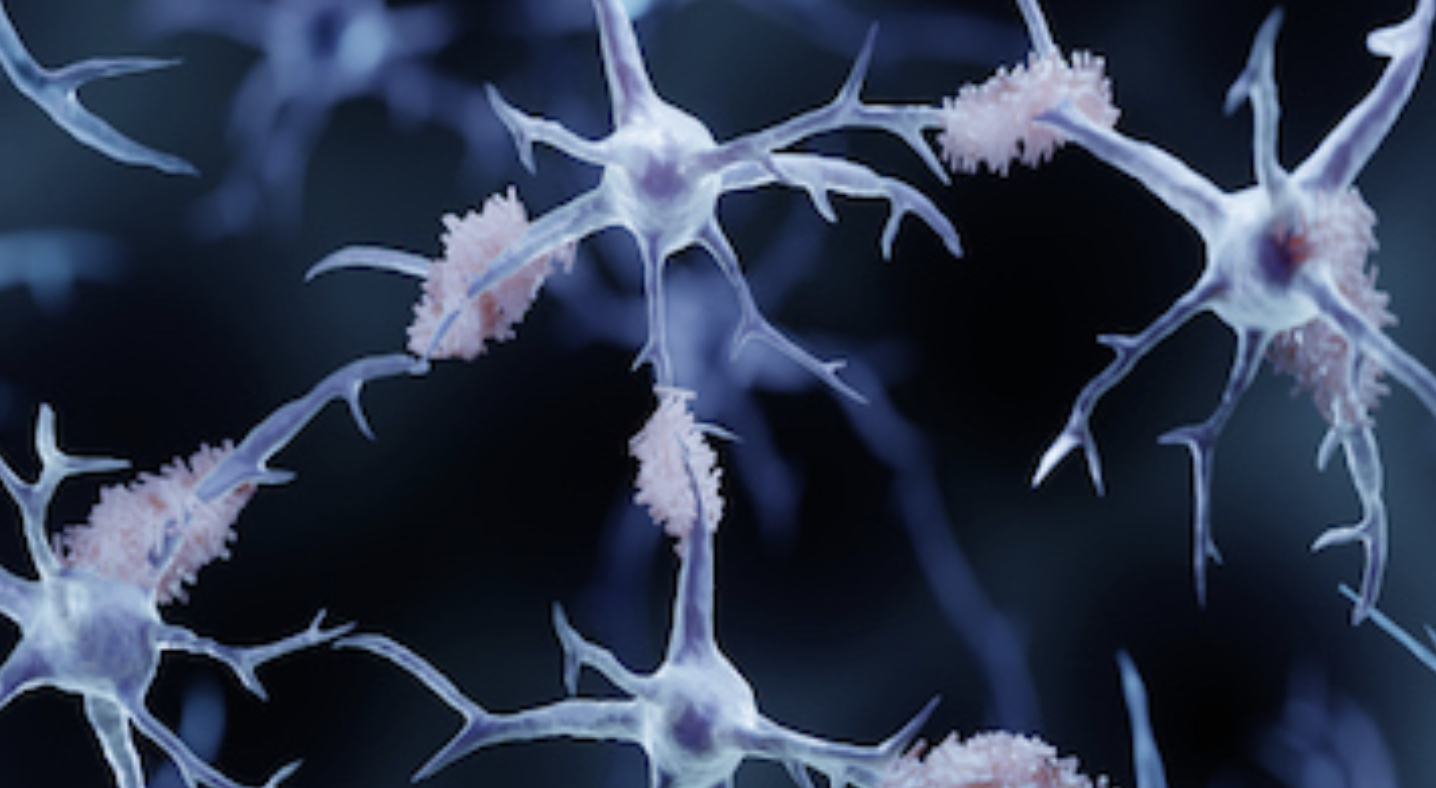
α-sécrétase et APPsα
Le site de clivage de l’α-sécrétase se trouve entre les résidus lysine 687 et leucine 688. Le fragment soluble APPsα relargué dans le milieu extracellulaire présente des propriétés neurotrophiques et neuroprotectives, cependant les mécanismes impliqués demeurent incompris.
ß-sécrétase et APPsß
La ß-sécrétase impliquée dans le clivage de l’APP entre les résidus méthionine 671 et Acide aspartique 672 est la protéase à acide aspartique BACE1 (ß-site APP-Cleaving Enzyme 1). L’activité BACE1 est présente dans la majorité des cellules et tissus, mais est particulièrement abondante dans le tissu neural, et plus précisément dans les neurones.
Le fragment soluble APPsß relargué suite au clivage par la ß-sécrétase présente des activités synaptotrophiques et neuroprotectives réduites, par rapport au fragment APPsα. Ces différences sont difficiles à comprendre car seuls 17 acides aminés diffèrent. Ceci pourrait être dû à un clivage spécifique d’APPsß, permettant sa fixation et l’activation d’un récepteur de mort. BACE1 est crucial à la formation de peptides Aß, il rend le fragment APP-CTFß (C99) accessible à la γ-sécrétase.
Les enzymes responsables de la coupure de l’APP en peptide amyloïde beta (ou Aß) ont été découvertes en 1999 comme étant des sécrétases, qui agissent sur la partie transmembranaire de l’APP. L’APP peut donc être clivée par trois complexes protéolytiques appelés α-, ß- et γ-sécrétases. Il existe deux voies différentes qui sont caractérisées par des clivages de types différents.
γ-sécrétase et AICD
La γ-sécrétase est un complexe protéolytique composé de quatre sous-unités essentielles. L’activité catalytique est portée par la sous-unité PS (Presenilin). Il existe deux homologues humains : PS1 et PS2. Elles comportent 9 domaines transmembranaires (TMD). La boucle cytoplasmique située entre les TMD6 et TMD7 peut subir un clivage qui stabiliserait la conformation des sites actifs situés dans ces TMD.
Trois autres protéines membranaires composent la γ-sécrétase: NCT, APH-1 (Anterior PHarynx-defective-1), et PEN-2 (Presenilin ENhancer-2). NCT effectue la reconnaissance des substrats : ceci nécessite l’élimination de la plus grande partie du domaine extracellulaire de celui-ci. PEN-2 est requis pour la stabilisation des deux fragments des PS au sein du complexe. La fonction d’APH-1 est floue. Il existe deux homologues humains : APH-1a et APH-1b. Le APH-1a existe sous deux isoformes issues d’un épissage alternatif. Six complexes coexistent donc chez l’Homme. Les spécificités de ces complexes ne sont pas connues. Il semble que le clivage par la γ-sécrétase se produise séquentiellement. APP-CTFß subit un premier clivage aux sites ε proches de la membrane plasmique. Le long fragment Aß enchâssé dans la membrane subit alors une série de clivage pouvant aboutir à des peptides Aß de différentes tailles comprises entre 37 et 49 acides aminés. Les peptides majoritaires au sein des plaques sont Aß40 et Aß42. Le clivage par la γ-sécrétase aboutit à la formation des peptides Aß, mais aussi à celle du fragment AICD.
La proteine TAU
Dans les années 1980, on n’était pas certain de la nature des dégénérescences neurofibrillaires, très présentes dans les neurones des patients Alzheimer. L’hypothèse dominante voulait qu’elles soient constituées d’éléments du cytosquelette. En 1985, Jean-Pierre Brion trouve un anticorps qui marque de façon sélective les dégénérescences neurofibrillaires de cerveaux Alzheimer, non pas en s’attachant directement avec des protéines du cytosquelette qui donnent leurs formes aux neurones, mais bien avec la protéine Tau « Tubulin Associated Unit » (en anglais) qui stabilise les cytosquelettes. D’autres équipes confirmèrent par la suite que la protéine Tau est l’élément principal des dégénérescences neurofibrillaires.