Les Transmembranaires
Les protéines transmembranaires sont des protéines incorporées et traversant la bicouche phospholipidique de la membrane cellulaire, associées étroitement via leur région hydrophobe centrale, exposant leurs extrémités hydrophiles de part et d’autre de la membrane, au contact des milieux aqueux. Les protéines transmembranaires interviennent dans la création du potentiel de repos et du potentiel d’action, et sont de deux types : les canaux ioniques et les pompes ioniques.
Les canaux transmembranaires sont des pores situés dans une bicouche lipidique. Ils sont formés par de grands complexes protéiques qui traversent la membrane, reliant le cytosol, ou cytoplasme, à la matrice extracellulaire. Les transporteurs membranaires sont des protéines intrinsèques à la membrane cellulaire, de nature lipidique qui permettent le transport des métabolites. Ils ont deux propriétés principales, être sélectifs et contrôlés de façon très fine. La membrane est imperméable aux molécules hydrophiles. Ceci permet d’éviter à la cellule de perdre son contenu et permet de séparer l’intérieur de l’extérieur. Mais les réactions chimiques s’effectuent pour la plupart en solution aqueuse et les transporteurs permettent de traverser la membrane pour atteindre l’endroit où ils seront destinés par l’intermédiaires des canaux, des pompes et des transporteurs.
Canaux
Les Canaux sont des protéines-canal assurant le transport passif de molécules à travers la membrane. Le passage à travers un canal suit les lois de la diffusion. Cependant elles peuvent être plus ou moins sélectives. Les canaux peuvent aussi se fermer et s’ouvrir en fonction de différents stimulus qu’il soit électrique, chimique ou mécanique. la définition du potentiel de la membrane est soumise à la sensibilité de certaines cellules et certains signaux extérieurs.
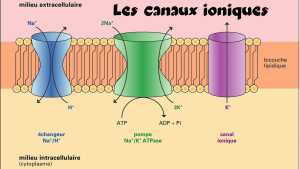
Les canaux ioniques
Les canaux ioniques principaux sont les canaux, sodiques (Na+), potassiques (K+), chloriques (Cl-) et calciques (Ca++). Certains canaux sont spécifiques pour un ion donné mais plusieurs canaux permettent le passage de plus d’une sorte d’ion.
Les pompes
Les pompes sont des canaux mais avec la particularité de fonctionner à l’envers des canaux ioniques, ce sont les pompes Na-K. A l’inverse des canaux ioniques, les pompes Na-K travaillent à contre-courant en retournant de façon continue les ions là où ils sont en grande concentration afin de maintenir les dosages inégales d’ions de part et d’autre de la membrane et à la repolarisation. Les pompes Na-K sont en fait des canaux ioniques particuliers fonctionnant à très haute consommation d’énergie.
Transport passif
Les canaux ioniques et les porines sont des pores constitués d’une ou plusieurs sous-unités protéiques transmembranaires. Le passage à travers la membrane nécessite peu de changements de configuration de la protéine de transport.
Les transporteurs actifs
Les transporteurs actifs sont très importants dans la cellule, car ils sont ceux qui concentrent le calcium du cytoplasme vers le réticulum endoplasmique et maintiennent ainsi une concentration cytosolique libre de l’ordre de la centaine de nanomoles. le calcium est utilisé par de nombreux récepteurs comme signal pour prévenir la cellule de la présence de sa molécule activatrice sur son site actif. Les co-transporteurs et les pompes sont formés de protéines plusieurs fois transmembranaires. Ces transporteurs n’ont pas de pore apparent. Le passage d’ions ou de petites molécules nécessite donc un profond changement de configuration. Ce transport est beaucoup plus lent mais permet aux solutés de traverser contre leur gradient électrochimique. Les co-transporteurs et les pompes transfèrent les molécules de soluté à travers la membrane selon le principe d’une réaction enzyme-substrat, tel que, E+S <–> ES –> E+P; (E étant le transporteur, S le soluté dans le compartiment initial, et P le soluté transféré dans le compartiment final). Cette approche permet la détermination de constantes physicochimiques Vmax et Km (Vmax pour vitesses max et Km pour constance de Michaëlis Menten) caractéristiques de chaque transporteur. Les transporteurs possèdent un ou plusieurs sites de fixation spécifiques du substrat. Cependant, à la différence d’une réaction enzyme-substrat, le soluté transporté n’est pas modifié. E+S→k1←k–1ES→k2 E+P.
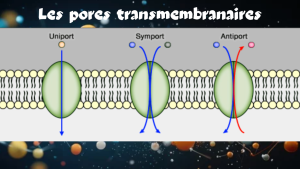
Les Transporteurs conduisent les molécules contre leur gradient électrochimique ne nécessite pas forcément l’hydrolyse de l’ATP. Il existe de nombreux cas où l’énergie est fournie par un ion ou une autre molécule qui suit son gradient électrochimique. Ce phénomène s’appelle transport couplé ou Co-transport, car il couple un canal ionique à une pompe membranaire et utilise l’énergie de l’un pour activer l’autre. Selon le sens de déplacement respectif des deux molécules on parle de symport, qui veut dire que l’ion et la molécule transportée traversent la membrane dans le même sens ou d’antiport, le cas ses deux espèces chimiques se déplacent en sens inverse. Ces transports couplés sont très utilisés par la cellule pour récupérer les molécules nécessaires à son métabolisme dans le milieu extérieur.
Protéines de transport
Les transporteurs sont des protéines transmembranaires qui comportent un site de fixation à l’ion ou/et à la molécule à transporter, ils subissent alors un changement de conformation qui leur permet de déverser l’ion ou la molécule fixé de l’autre côté de la membrane. Les transports actifs ne fonctionnent qu’en présence d’énergie métabolique (ATP). Sans cette source d’énergie, elles ne sont pas capables de lutter contre les forces du gradient électrochimique.
Passage par diffusion simple
Ce mode de transport ne fait pas intervenir de protéines membranaires. Il est limité aux gaz tel que, le N2, l’O2, le CO2, et le NO, et les molécules lipophiles comme les hormones stéroïdiennes et thyroïdiennes, l’urée, l’éthanol et dans certaines limites du H2O.
Passage par protéines de transport
La diffusion par un transporteur augmente très largement la vitesse et la sélectivité de transport par rapport à la diffusion simple. Le transporteur de glucose, comme la perméase GLUT-1 illustre bien ces deux aspects. La diffusion par un transporteur permet également de transporter les solutés contre leur gradient chimique et électrique. Le transport réalisé contre le gradient électrique ou chimique consomme de l’énergie et on parle alors de transport actif. Le transport actif permet le maintien de concentrations de solutés différentes de part et d’autre de la membrane.
Comportement des molécules chargées
La sélectivité de transport dépend de la nature des canaux. Pour les canaux ioniques le passage semble être déterminé par deux paramètres, les forces électrostatiques à l’intérieur du canal et le diamètre du port. L’intérieur des canaux anioniques, comme le chlorure, CI-, est faiblement positif et celui des canaux cationiques, comme potassique, K+, est faiblement négatif. L’ion est alors attiré par la faible charge opposée et se positionne au milieu du canal dans un environnement électrostatique favorable.
Pour la majorité de canaux ioniques, les ions qui entrent perdent la plupart des interactions électrostatiques avec l’eau et établissent de nouvelles interactions avec le pore. Il traversera complètement à la suite de l’entrée d’autres ions de même charge qui le repousseront vers l’autre côté du canal. Le mécanisme proposé justifie le principe du passage des ions en fonction de leur gradient de concentration. La différence de potentiel électrique au travers de la membrane joue aussi un rôle important parce qu’elle peut s’opposer à la sortie des ions.
Maintien des concentrations ioniques
L’ATPase Na+/K+ ou pompe NA+/K+, La concentration en K+ est typiquement 30 à 40 fois plus élevée à l’intérieur des cellules qu’à l’extérieur, alors que la situation est inversée pour Na+. Ces différences sont engendrées et maintenues par une ATPase de la membrane plasmique qui se comporte comme une pompe expulsant activement 3 ions Na+ vers l’extérieur de la cellule et important deux ions K+ vers l’intérieur. L’ATPase Na+/K+ diminue ainsi la concentration intracellulaire d’ions positifs. Elle est donc électrogénique et est impliquée dans la mise en place d’un potentiel électrique membranaire. Le transport de Na+ et K+ est étroitement couplé à l’hydrolyse de l’ATP pour le transfert des deux ions contre leur gradient électrochimique.
L’ATPase Na+/K+, de classe P, comme la plupart des autres pompes, est constituée de trois protéines étroitement liées (sous-unités α,β,λ, respectivement d’un poids moléculaire de 110 kDa, 40 kDa et 8 kDa). Son mécanisme moléculaire de transport exige trois étapes, la fixation des ions à haute affinité, transfert des ions au travers de la membrane, et réduction d’affinité qui permet la libération des ions. Le gradient Na+/K+ généré de part et d’autre de la membrane est essentiel au fonctionnement de la cellule. Il est impliqué dans diverses fonctions, par, régulation du pH, régulation du volume cellulaire, transport de nutriments tels que glucose et certains acides aminés et transmission du signal dans le système nerveux par potentiel d’action.
La différence de potentiel
La différence de potentiel transmembranaire, ou potentiel de membrane, d’une cellule animale est proche de -70 milli Volt, la face cytoplasmique étant chargée négativement par rapport à la face externe. Le potentiel de membrane est le résultat de mouvements ioniques transmembranaires. Ces mouvements sont la conséquence d’une distribution inégale de part et d’autre de la membrane des ions et macromolécules chargées comme les glucides complexes, les nucléotides et les protéines. Cette distribution est elle-même la conséquence de transports transmembranaires actifs avec une contribution majeure de l’ATPase Na+/K+.
Dans un état repos c’est le mouvement de K+ au travers de la membrane qui prédomine, parce qu’il y a plus de canaux potassiques que de canaux sodiques ouverts. En conséquence, la valeur du potentiel de repos est essentiellement déterminée par le mouvement de K+. Grâce à sa concentration intracellulaire très élevée, le K+ sort de la cellule en polarisant la face cytoplasmique négativement par rapport à la face externe. Le potentiel ainsi créé s’oppose au mouvement suivant de K+ au travers de la membrane, c’est-à-dire que le gradient électrochimique de K+ diminue. Sans la présence de Na+, le potentiel atteint la valeur de moins de 90 milli Volt, une valeur pour laquelle il y a équilibre entre les deux forces. Cependant, le potentiel de membrane créé par le K+, induit une augmentation considérable du gradient électrochimique du Na+, ce qui provoque un flux entrant de Na+ de plus en plus important. A un moment donné, il s’installe un équilibre dynamique où il y autant de K+ qui sortent que de Na+ qui entrent, c’est le potentiel de membrane de repos.
Sources & références